自閉症に対する幹細胞治療の系統的考察 論文要約
自閉症に対する幹細胞治療の系統的考察
Stem Cell Therapy in the Treatment of Patients With Autism Spectrum Disorder: a Systematic Review and Meta-analysis
今回、2022年にVillarreal-Martínez博士らがStem Cell Reviews and Reports誌に報告した自閉スペクトラム症に対する幹細胞療法のメタ解析と系統的レビューについて日本語訳を作成しましたので、以下掲載します。
Villarreal-Martínez et al. Stem Cell Reviews and Reports. 2022 Jan;18(1):155-164から改変転載
抄録
目的 自閉症患者に対する最近の幹細胞治療の安全性と有効性を、特に認知障害や行動障害の面から評価、分析した。
方法 自閉スペクトラム症に対する幹細胞療法についての最近の対照試験や非対照試験、ランダム化試験、非ランダム化試験について調査した。データソースとして、Scopus、Web of Science、MEDLINE、EMBASEを用いた。対照群がない研究に対するバイアスリスクは、コクランとNIH の品質評価法を用いて評価した。
結果 計461名の患者を含む11個の臨床試験が本解析の基準を満たした。ABC(Autism Behavior Checklist)スケールについて報告した試験のメタ解析は、治療群の平均スコアは -11.97 (95 % 信頼区間 -91.45 ~ 67.52、p < 0.01) であった。 CARS(Childhood Autism Rating Scale)スケールについて報告した試験のメタ解析は、治療群の平均スコアは-9.08 (95 % 信頼区間 -15.43 ~ -2.73、p < 0.01) であった。 VABS(Vineland Adaptive Behavior Scales)スケールについて報告した試験は各項目ごとに報告されており、コミュニケーション能力は平均 2.69 (95 % 信頼区間1.30 ~ 4.08、p = 0.92)、日常生活能力は1.99 (95 % 信頼区間0.83 ~ 3.15、p = 0.51)、運動能力は1.06 (95 % 信頼区間 -0.37 ~ 2.48、p = 0.20)、社会的能力は3.09 (95 % 信頼区間 1.71 ~ 4.48、p = 0.61)、適応行動能力は2.10 (95 % 信頼区間 1.04 ~ 3.16、p = 0.36)であった。そして最も一般的な副作用は、発熱や多動、嘔吐、頭痛であり、重篤な有害事象は含まれていなかった。(※筆者コメント このような副作用は主に髄空内に直接投与する方法、他人の幹細胞(兄弟を含む)、培養した幹細胞投与で発生しており、自分のものを培養せずに投与する方法ではこのような副作用は確認されておりません)
結論 一連の臨床試験から幹細胞療法は自閉スペクトラム症を有意に改善することが示唆されており、今後の研究はさらなる信頼の確立に寄与するはずである。そしてこれまで幹細胞療法に関連した重篤な有害事象がみられたという報告がないことも付記する。
当院の治療内容はこちらから自閉症(自閉症スペクトラム)、発達障害の最新治療、間葉系骨髄血幹細胞移植治療ご覧いただけます。
自閉症に対する幹細胞治療の系統的考察本文
背景
自閉スペクトラム症 (ASD) は、一連の複雑な神経発達障害である [1]。自閉症は ASD の中でも最も頻度が高い疾患であり、生後早期に発症し、社会的なコミュニケーションや交流の欠如、限局した興味、反復的かつ常同的な言語的又は非言語的な行動によって特徴付けられる [2]。昨今、早期診断法や行動療法は進歩したにもかかわらず、効果的な治療法は確立されたとは言い難い[3、4]。現状の治療法は、向精神薬、行動療法、作業療法、言語療法、専門的な教育および職業支援が挙げられる[5、6、7、8]。そしてASD患者において、神経炎症や神経回路の異常所見がある場合、神経炎症や神経回路を制御するための治療的介入が有効であるという結果が報告されている [9]。さらに最近、幹細胞治療によってASD における神経学的な異常が改善したことがいくつも報告されている [9、10、11、12]。
これまでの動物実験の研究から、間葉系幹細胞(Mesenchymal Stem Cells, MSC)は神経に対して、保護的な作用や神経新生作用、シナプス形成促進作用をもたらすことが分かってきた[13、14、15、16、17、18、19]。そして、それらの研究がきっかけとなり、ASDを持つ子供達の治療のために幹細胞の移植が行われるようになった[11、20、21、22、23]。 これまでに検討されたアプローチには、自己骨髄からの単核球 (bone marrow mononuclear cell, BMMNC)の移植や [21、22]、他人由来もしくは自己の臍帯血から取り出した単核球 (cord blood mononuclear cell, CBMNC)の移植、又はそれと臍帯由来の MSCを組み合わせて移植する手法 [11、23]が報告されている 。また細胞の投与経路としては、髄腔内もしくは静脈内への投与が選択されてきた。これらの研究結果は概ね一致しており、ASDの行動異常や、社会的スキルや言語障害、脳代謝をそれぞれ改善し、安全性についての懸念もない。しかしその一方で、最適な投与経路や細胞の種類、調整方法、投与量について、より優れた治療効果をもたらすにはどうすればよいのか未知な点も多い。そのような背景から、今回我々はこれまでの幹細胞治療の安全性と有効性ならびにASDの認知障害や行動障害に対する効果について、系統的レビューとメタ解析を行った[11]。
方法
研究デザイン
この研究は、Preferred Reporting Items for Systematic review and Meta-Analysis (PRISMA)の手順に準ずる。 またInternational Prospective Register of Systematic Reviews (PROSPERO) に番号CRD42021225190 で登録されている。
臨床試験の適合基準
自閉スペクトラム症の治療法として幹細胞療法の効果を評価した対照試験や非対照試験、ランダム化試験、および非ランダム化試験を対象とした。プラセボ群と比較した試験のみでなく、比較対照なしでも可とした。主要関心項目は臨床評価尺度の改善であり、 副次関心項目としては、画像検査上の変化と有害事象を入れた。英語以外の言語を使用した研究は除外した。
文献の検索方法とデータ管理
経験豊富な司書(イニシャルE.G.L.)が、主任研究者からの情報をもとに検索方法を考え、本研究に参加した研究者全員の承諾のもと実施した。Scopus、Web of Science、MEDLINE、EMBASE のオンラインデータベースについて、それらの収載開始年時から 2020 年 11 月までの文献を検索した。さらに見逃した可能性のある臨床研究を洗い出すために、この分野の専門家にも相談しながら、文献検索を行った。補足情報欄に詳しい検索方法を記載した (補足 A1、A2) 。 文献の重複を排除するためEndNote X8にアップロードし、そこから抄録と全文の両方を Distiller Systematic Review (DSR) にアップロードした。
研究の採用過程
文献に記載された研究を採用するかの審査過程は2段階に分けた。4人の審査担当者 (イニシャルG.G.M.、M.S.F.、A.J.B.G.、A.G.M.) が独自に作業をすすめ、我々の解析に適合するかについて一つの文献について二人が評価した。審査担当者の意見が一致するかを確認するのにカッパ係数を用いた。まず4人の基準に違いがないかを確認するため、審査前に簡単な予備テストを行ない、カッパ係数が 0.7以上 に達するまでテストを繰り返した。審査の第 1 段階では、文献のタイトルと要約のみから各担当者が適合基準に基づいて研究を審査、取捨選択した。この段階では研究の取りこぼしがないように、二人の担当者間で意見が違う場合とりあえず次の審査を行うことにした。審査の第 2段階では、文献の本文から適合性を評価した。この段階で担当者間で意見が違う場合は、話し合いを行い採用するか否か決めた。
データの収集過程
採用となった各研究について先ほどの4人の審査担当者 (G.G.M.、M.S.F.、A.J.B.G.、A.G.M.)のうち二人が各々独立してブラウザベースの収集フォームを使いデータを収集した。各研究について、 研究設定、タイトル、著者情報、出版年、患者のベースライン特性 (年齢、性別、人種、併存疾患)、治療方法、有害事象、画像検査(あれば)、治療改善点、についての情報を収集した。この段階で担当者二人が収集した情報に食い違いが見られた場合、二人の話し合い、もしくは別の審査担当者の意見によって、情報を一致させた。対照群を設けた研究については、介入群(治療群)からの患者データのみを抽出した。
各研究がもたらすバイアスのリスク
各研究がもたらすバイアスリスクについて、4人の審査担当者 (G.G.M.、M.S.F.、A.J.B.G.、A.G.M.) うち二人が各々独立して評価した。比較対象群をおいたランダム化試験におけるバイアスリスクを評価するため、コクランリスクオブバイアス2.0(RoB2.0)を用いた。この手法は、(1)無作為化の過程から生じるバイアス,(2)意図した介入からの逸脱によるバイアス,(3)転帰データの欠落によるバイアス,(4)結果の測定におけるバイアス,(5)報告された結果の選択におけるバイアス、という5つのポイント(ドメインと呼ばれる)を評価するものである。 各研究はそのバイアスについて、高い、懸念あり、低いという3段階で評価された。対象群のいないシングルアーム試験については、該当する NIHの品質評価ツールを使用したが、それは患者特性やアウトカム、介入方法、その他の方法論的な特徴について評価するものである。それらの研究の品質は、良好、普通、悪いの3段階で評価された。 担当者間で意見が違う場合は、話し合いにより意見を一致させた。
データの作成と統計分析
まず我々の適合基準を満たした研究を文章として要約した。可能な場合は、PROSPERO にてあらかじめまとめた結果を用いて、幹細胞療法の治療効果を推定するためのメタ解析を実施した。1つの試験で複数の介入群が存在する場合、介入に関する系統的レビューのコクランハンドブック [24] に従って、複数の独立した比較を含めるために必要な群に分けた。
定量的なデータの作成については、単一平均のランダム効果メタ分析と呼ばれる手法を用いて全体平均を計算するとともに、逆分散加重法を用いて介入群における治療前後のスコアの単一平均を集積していった[25]。また不均一性については、コクランの Q テスト (p 値 < 0.10 によって決定される高い不均一性) ならびに、値 が25 %以下場合を低い不均一性とし、75 %以上を高い不均一性とする I2 検定を用いて算出した。
介入効果がカテゴリ変数の場合は頻度とし、連続変数の場合は平均値または中央値を算出した。コクランハンドブックに記載された介入群を統合するための式を用いて、各試験の平均値と標準偏差 (SD) を統合した。可能な場合は、R (バージョン 4.0) と R Studio (バージョン 1.2.5001)の「メタ」パッケージ を使用して、改変率を計算するための一般化線形混合効果モデルを使用した変量効果メタ解析を行った。
結果
文献の検索結果
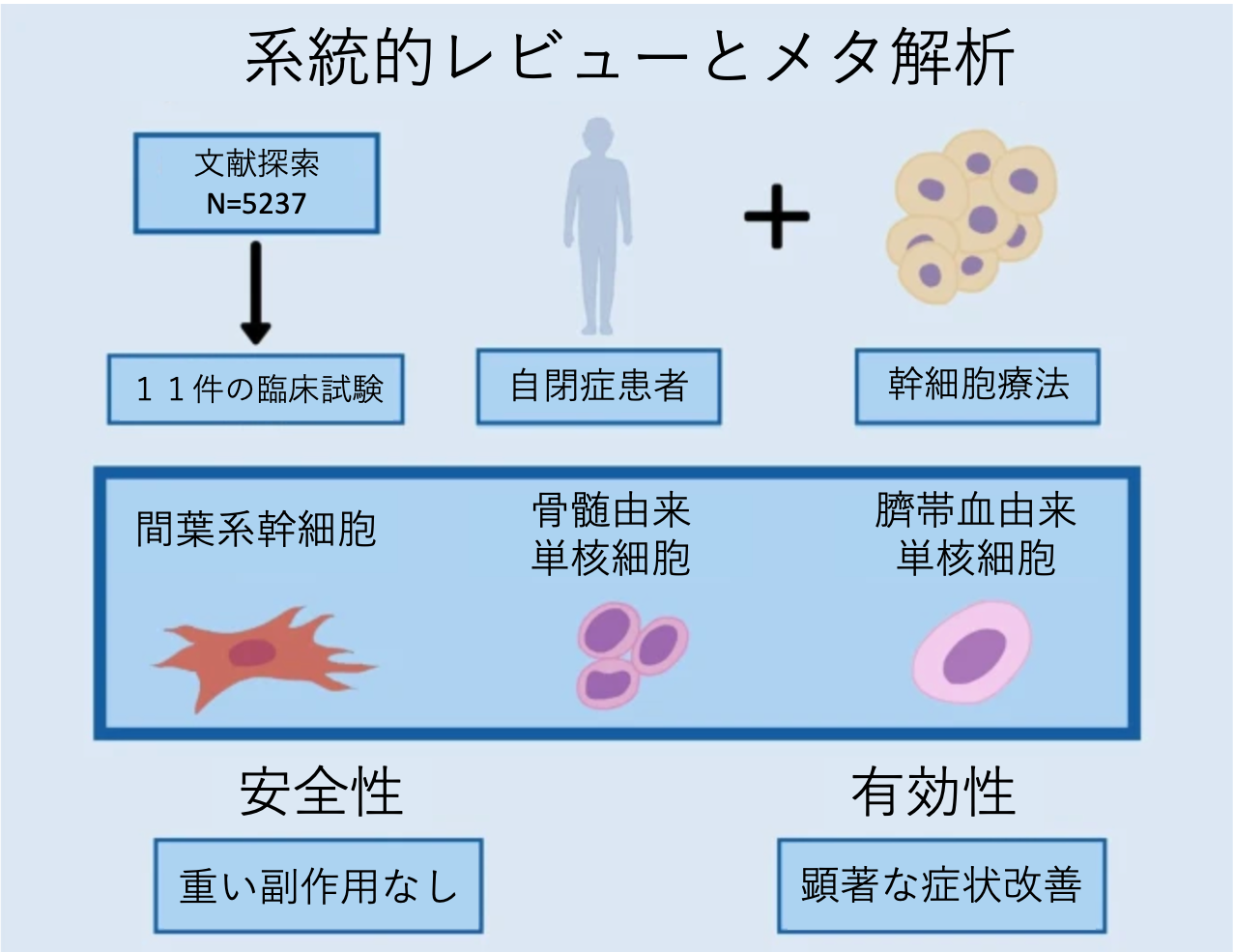
合計 5,237 件の文献がオンラインデータベースから見つかった。プロトコールのみのもの、重複参照、適合基準を満たしていないもの、などを除いた結果、11件の研究が本解析の対象となった。これらは対象群のいないシングルアーム試験もしくは対照群がいる比較試験であった。
研究の特徴
適合した11件の研究の被験者について、年齢幅が2歳から33歳、人数は12人から180人、追跡期間は6ヶ月から26ヶ月であった。テーブル1にその概要を示す。投与された幹細胞の種類は、6 つの研究では自己臍帯血細胞 [9、23、26、27、28、29]、3つの研究で骨髄単核細胞[11、21、30]、一つの研究では間葉系間質細胞の静脈内注入が行われた。一つの研究では胎児由来幹細胞移植が実施された[31]。またほとんどの研究は、幹細胞療法の有効性と安全性について調べることがメインアウトカムであった。

解析対象となった11件の臨床試験
評価スケール
対象とした文献全体では、以下に説明する14個の評価スケール(尺度)が用いられていた。自閉症診断観察尺度 (Autism Diagnostic Observation Schedule、ADOS)、ヴァインランド適応行動尺度 (Vineland Adaptive Behavior Scales、VABS)、自閉症臨床全体印象度 (Autism Clinical Global Impression、CGI)、表現的一語画像語彙テスト (Expressive One-Word Picture Vocabulary Test、EOWPVT)、受容的一語画像語彙テスト(Receptive One-Word Picture Vocabulary Test、ROWPVT)、自閉症治療評価チェックリスト (Autism Treatment Evaluation Checklist 、ATEC)、小児自閉症評価尺度 (Childhood Autism Rating Scale 、CARS)、自閉症行動チェックリスト (Autism Behavior Checklist、ABC)、インド自閉症評価尺度 (Indian Scale for Assessment of Autism、ISAA)、機能的自立度評価表 (Functional Independence Measure、FIM)、こどものための機能的自立度評価法 (Wee Functional Independence Measure、WeeFIM)、広汎性発達障害行動インベントリ (Pervasive Developmental Disorder Behavior Inventory、PDDBI)、発達指数 (Development Quotient 、DQ)、およびスタンフォード‐ビネー知能スケール(Stanford Binet)である。メタ解析は、2 つ以上の論文で報告されたABC スケール、CARS スケール、VABS スケールの3つの評価スケールについて行った。
ABCスケール
2つの研究では ABC スケールで治療効果が報告されている [11、31] 。メタ解析の結果、介入群の平均値はマイナス11.97点であった(95 % 信頼区間 -91.45~67.52、I2 = 99 %、p < 0.01、図2)。
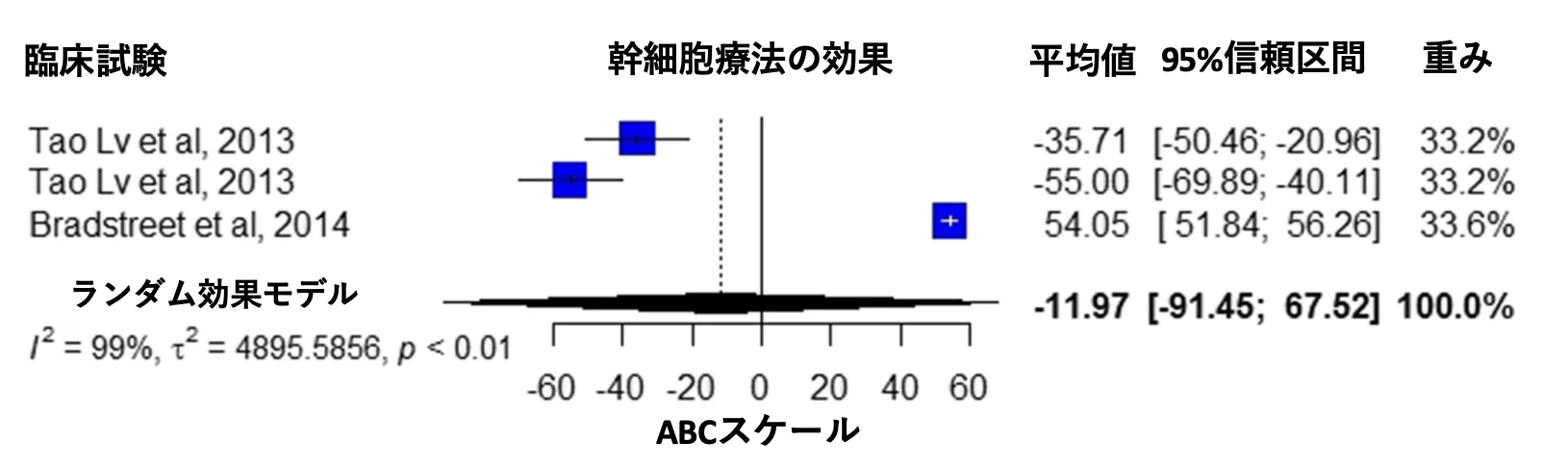
図2 Villarreal-Martínez et al. Stem Cell Reviews and Reports. 2022 Jan;18(1):155-164から改変転載
CARSスケール
3つの研究では CARS スケールで治療効果が報告されている[11、26、30] 。 メタ解析の結果、介入群の平均値はマイナス9.08点であった (95 %信頼区間 -15.43 ~ -2.73、I2 = 88 %、p < 0.01、図 3)。
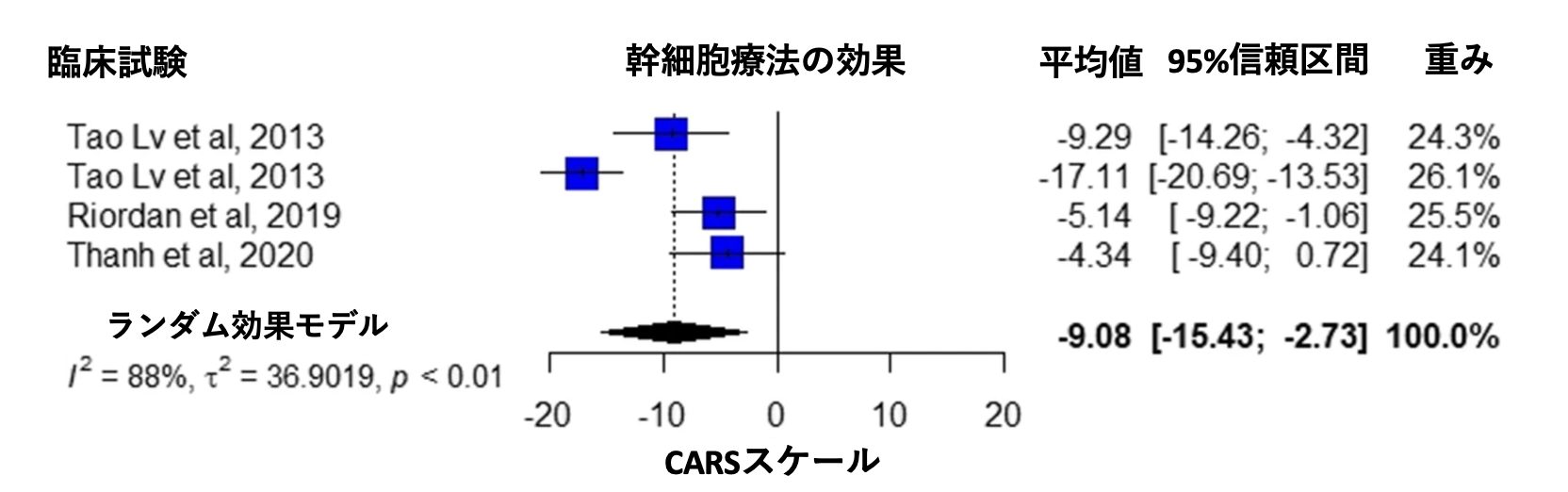
図3 Villarreal-Martínez et al. Stem Cell Reviews and Reports. 2022 Jan;18(1):155-164から改変転載
VABS スケール
4 つの研究では、VABS スケール、コミュニケーション領域での治療効果が報告されている [23、27、28、30] 。 メタ解析の結果、介入群の平均値は 2.69点であった (95 %信頼区間 1.30 ~ 4.08、I2 = 0 %、p = 0.92、図 4a) 。VABS スケールの日常生活領域は 4 つの研究で報告されており [23、27、28、30]、メタ解析の結果、介入群の平均値 1.99点であった (95 % 信頼区間 0.83 ~ 3.15、I2 = 0 %、p = 0.51、図 4b)。 運動ドメインは 4 つの研究で報告されており[23、27、28、30]、メタ解析の結果、平均値 1.06点であった(95 %信頼区間 -0.37 ~ 2.48、I2 = 28 %、p = 0.20、図 4c)。社会的領域は 3 つの研究で報告されており[23、28、30]、メタ解析の結果、介入群の平均値は 3.09点であった (95 %信頼区間 1.71 ~ 4.48、I2 = 0 %、p = 0.61、図 4d) 。 適応行動能力は3 つの研究で報告されており[23、27、28]、メタ解析の結果、介入群の平均値は2.10点であった(95 %信頼区間 1.04〜3.16、I2 = 9 %、p = 0.36、図4e)。
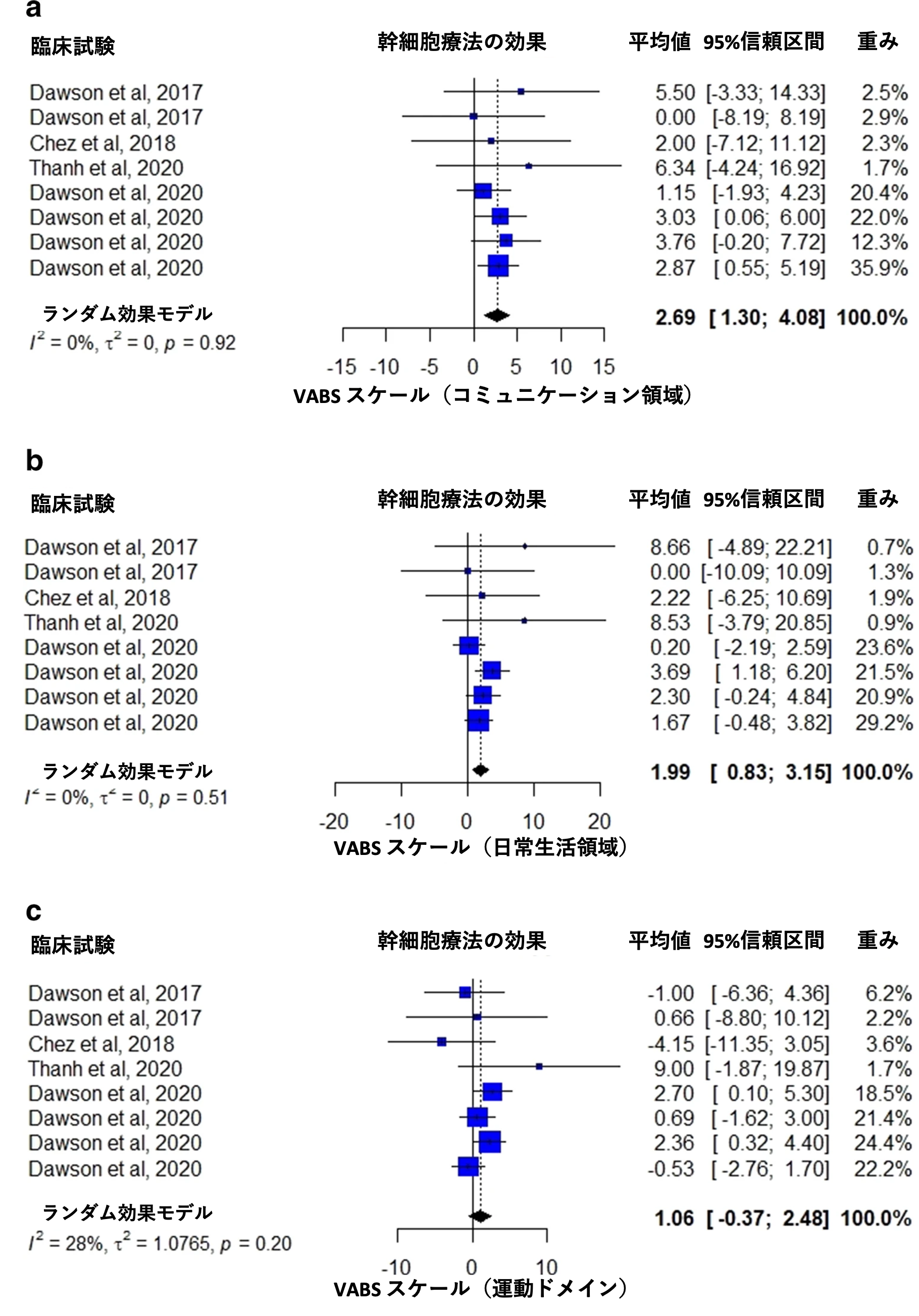
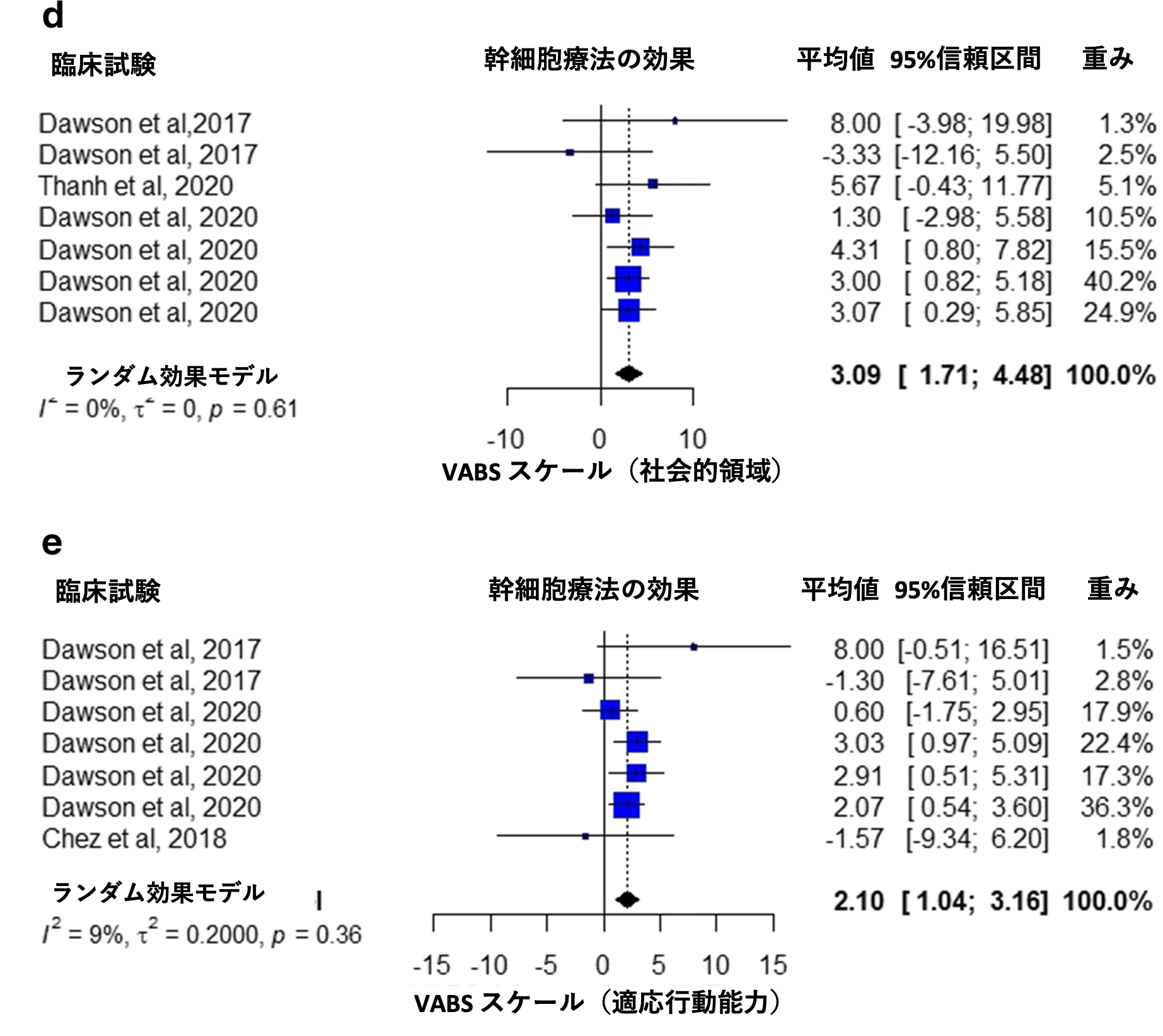
図4 Villarreal-Martínez et al. Stem Cell Reviews and Reports. 2022 Jan;18(1):155-164から改変転載
有害事象
幹細胞治療の有害事象(副作用)を報告した5つの研究を対象に割合メタ分析を行った。4つの研究では発熱が31 %(p = 0.02、I2 = 61 %)、3つのの研究で頭痛が13 %(p = < 0.001、I2 = 78.6 %)、4つの研究では嘔吐が25%(p = < 0.001、I2 = 72 %)、また3つの研究では多動性が27% (p = 0.07、I2= 46.3 %)、3つの研究では攻撃性が14% (p = 0.39、I2= 0.0 %)、それぞれ報告されていた。
画像検査
6つの研究では画像診断結果が報告された。ある研究ではMRI を使用し、自閉症病態に以前から関連付けられていた大脳辺縁系や前頭葉、側頭葉および大脳基底核の神経回路接続の増加と行動改善が関連付けられた [9] 。別の研究では、8 人の患者に対して PET-CT スキャンを使用し、 細胞療法後の糖取り込みの増加が、6人の患者においては前頭葉と頭頂葉、5人の患者においては後頭葉と側頭葉、4人の患者においては小脳。 3人の患者においては、扁桃体、海馬、海馬傍でも、さらに 5人の患者においては、帯状回、帯状回野、大脳基底核にて観察された。一方で介入前の PET-CT スキャンでは、前頭葉、小脳、扁桃体、海馬、海馬傍、および内側側頭葉の領域における FDG 取り込みの減少が示されるとともに、 介入から 6 か月後でも、これらと同じ領域での糖取り込みの増加が確認された [21] 。また別の研究では、脳波検査(EEG)が行われ、特定の両側前頭葉優勢な全般性または局所的なスパイク波活動が側頭頭頂部中央領域で確認された[27]。また別の研究でも、EEGを使用して治療グループ間の主効果を明らかにした[28]。さらにもう一つの研究 では、細胞治療12か月後の EEG スペクトル特性の正規化に反映される EEG パワーの顕著な変化が示された[29] 。治療前のEEGベータ2パワーが高いほど、社会的コミュニケーション症状の改善の度合いが高く、さらに EEG ベータ 2 パワーと NVIQ のベースライン測定値を組み合わせると治療反応を高度に予測することができ、EEGの有用性が示唆された[29] 。PETスキャンを使用した研究では、統計的に有意ではなかったものの、治療前は代謝が低下していた頭頂葉、前頭葉、前帯状回の領域が、治療後にはその代謝が改善していた[30]。
バイアスのリスク
コクランリスクオブバイアスを使用して 3 つの研究を評価したところ、 バイアスのリスクが低い研究[11]とともに、何らかの懸念がある研究 [27]やバイアスのリスクが高い研究 [28]があることが判明した。後者二つの研究について、いずれも当初計画された介入からの逸脱があったほか、高リスクと分類された最後の研究は、さらに被験者のランダム化割り付け過程に対する懸念が見つかった。
また NIH の品質評価ツールを使用して8つの研究 [5、9、21、23、26、29、30、31]を評価したところ、6つの研究 [5、9、21、23、26、29]は普通、2つの研究[30、31]は良好であった。
考察
主な結果
今回の系統的レビューは、自閉症に対する幹細胞療法の最近の臨床試験の結果を要約したものであり、 一連の研究から、幹細胞療法が自閉症スペクトラム症の評価スコアを大幅に改善することを示唆するとみられる。報告されてた有害事象には、発熱、活動亢進、嘔吐、頭痛、攻撃性があるものの、それは 重篤なものではない。もう一つ分かった重要な発見は、画像検査上の改善であり、1つの研究ではMRI上での神経活動の増加とともに、PET-CTを使用した2つの研究では幹細胞治療後に脳の代謝改善が見られ、EEGを使用した3つの研究から治療反応の予測可能性について提起された。
結論
幹細胞療法を含めた再生医療は、治療法の選択肢がない病気を治すため研究が進められている。自閉症についても、根治療法がなく、治療の選択肢は限られている。今回の研究では、自閉スペクトラム症に対する幹細胞治療の安全性と有効性を調べた最近の臨床試験をメタ解析した。過去の研究と比較しても最も包括的な調査である。幹細胞治療に関連した重篤な有害事象はなく、最近の一連の研究結果は、細胞のソース、投与量、投与経路に関係なく、幹細胞療法が自閉症スペクトラム症の改善に有効であることを示している。今回の結果は、患者や臨床医が、多くの情報に基づいた上でも、幹細胞療法は有効でありまたリスクが少ないということを理解するのに役立つはずである。
参考文献
-
- Theoharides, T. C., Kempuraj, D., & Redwood, L. (2009). Autism: an emerging “neuroimmune disorder” in search of therapy. In Expert Opinion on Pharmacotherapy(Vol. 10, Issue 13, pp. 2127–2143). https://doi-org.osaka-u.idm.oclc.org/10.1517/14656560903107789
- American Psychiatric Association. (2013). Diagnostic and Statistical Manual of Mental Disorders (DSM-5®). American Psychiatric Pub
- Siniscalco, D., Kannan, S., Semprún-Hernández, N., Eshraghi, A. A., Brigida, A. L., & Antonucci, N. (2018). Stem cell therapy in autism: recent insights. In Stem Cells and Cloning: Advances and Applications (Vol. 11, pp. 55–67). https://doi-org.osaka-u.idm.oclc.org/10.2147/sccaa.s155410
- de Magistris, L., de Magistris, L., Picardi, A., Siniscalco, D., Riccio, M. P., Sapone, A. … Bravaccio, C. (2013). Antibodies against food antigens in patients with autistic spectrum disorders. In BioMed Research International (Vol. 2013, pp. 1–11). https://doi-org.osaka-u.idm.oclc.org/10.1155/2013/729349
- Sun, J. M., Dawson, G., Franz, L., Howard, J., McLaughlin, C., Kistler, B. … Kurtzberg, J. (2020). Infusion of human umbilical cord tissue mesenchymal stromal cells in children with autism spectrum disorder. In STEM CELLS Translational Medicine (Vol. 9, Issue 10, pp. 1137–1146). https://doi-org.osaka-u.idm.oclc.org/10.1002/sctm.19-0434
- Payakachat, N., Tilford, M., Kovacs, J., & Kuhlthau, K. (2012). Autism spectrum disorders: a review of measures for clinical, health services and cost–effectiveness applications. Expert Review of Pharmacoeconomics & Outcomes Research, 12(Issue 4), 485–503. https://doi-org.osaka-u.idm.oclc.org/10.1586/erp.12.29
- Ellison-Wright, Z., & Boardman, C. (2015). Diagnosis and management of ASD in children and adolescents. Progress in Neurology and Psychiatry, 19(6), 28–32
- Nevels, R. M., Dehon, E. E., Alexander, K., & Gontkovsky, S. T. (2010). Psychopharmacology of aggression in children and adolescents with primary neuropsychiatric disorders: a review of current and potentially promising treatment options. Experimental and Clinical Psychopharmacology, 18(2), 184–201
- Carpenter, K. L. H., Major, S., Tallman, C., Chen, L. W., Franz, L., Sun, J. … Dawson, G. (2019). White matter tract changes associated with clinical improvement in an open-label trial assessing autologous umbilical cord blood for treatment of young children with autism. In STEM CELLS Translational Medicine (Vol. 8, Issue 2, pp. 138–147). https://doi-org.osaka-u.idm.oclc.org/10.1002/sctm.18-0251
- Boncoraglio, G. B., Ranieri, M., Bersano, A., Parati, E. A., & Del Giovane, C. (2019). Stem cell transplantation for ischemic stroke. Cochrane Database of Systematic Reviews, 5, CD007231
- Lv, Y. T., Zhang, Y., Liu, M., Qiuwaxi, J. N. T., Ashwood, P., Cho, S. C. … Hu, X. (2013). Transplantation of human cord blood mononuclear cells and umbilical cord-derived mesenchymal stem cells in autism. Journal of Translational Medicine, 11, 196
- Nguyen, L. T., Nguyen, A. T., Vu, C. D., Ngo, D. V., & Bui, A. V. (2017). Outcomes of autologous bone marrow mononuclear cells for cerebral palsy: an open label uncontrolled clinical trial. BMC Pediatrics, 17(1), 104
- Spejo, A. B., Carvalho, J. L., Goes, A. M., & Oliveira, A. L. R. (2013). Neuroprotective effects of mesenchymal stem cells on spinal motoneurons following ventral root axotomy: synapse stability and axonal regeneration. Neuroscience, 250, 715–732
- Ziv, Y., Finkelstein, A., Geffen, Y., Kipnis, J., Smirnov, I., Shpilman, S. … Yoles, E. (2007). A novel immune-based therapy for stroke induces neuroprotection and supports neurogenesis. Stroke; a Journal of Cerebral Circulation, 38(2 Suppl), 774–782
- Shen, L. H., Li, Y., Chen, J., Zacharek, A., Gao, Q., Kapke, A. … Chopp, M. (2007). Therapeutic benefit of bone marrow stromal cells administered 1 month after stroke. Journal of Cerebral Blood Flow and Metabolism: Official Journal of the International Society of Cerebral Blood Flow and Metabolism, 27(1), 6–13
- McTighe, S. M., Neal, S. J., Lin, Q., Hughes, Z. A., & Smith, D. G. (2013). The BTBR mouse model of autism spectrum disorders has learning and attentional impairments and alterations in acetylcholine and kynurenic acid in prefrontal cortex. PLoS One, 8(4), e62189
- Segal-Gavish, H., Karvat, G., Barak, N., Barzilay, R., Ganz, J., Edry, L., & Kimchi, T. (2016). Mesenchymal stem cell transplantation promotes neurogenesis and ameliorates autism related behaviors in BTBR Mice. Autism Research: Official Journal of the International Society for Autism Research, 9(1), 17–32
- Perets, N., Segal-Gavish, H., Gothelf, Y., Barzilay, R., Barhum, Y., Abramov, N. … Offen, D. (2017). Long term beneficial effect of neurotrophic factors-secreting mesenchymal stem cells transplantation in the BTBR mouse model of autism. Behavioural Brain Research, 331, 254–260
- Ha, S., Park, H., Mahmood, U., Ra, J. C., Suh, Y. H., & Chang, K. A. (2017). Human adipose-derived stem cells ameliorate repetitive behavior, social deficit and anxiety in a VPA-induced autism mouse model. In Behavioural Brain Research (Vol. 317, pp. 479–484). https://doi-org.osaka-u.idm.oclc.org/10.1016/j.bbr.2016.10.004
- Price, J. (2020). Cell therapy approaches to autism: a review of clinical trial data. Molecular Autism, 11(1), 37
- Sharma, A., Gokulchandran, N., Sane, H., Nagrajan, A., Paranjape, A., Kulkarni, P. … Badhe, P. (2013). Autologous bone marrow mononuclear cell therapy for autism: an open label proof of concept study. Stem Cells International, 2013, 623875
- Bansal, H., Verma, P., Agrawal, A., Leon, J., Sundell, I. B., & Koka, P. S. (2016). A short study report on bone marrow aspirate concentrate cell therapy in ten South Asian Indian patients with autism. Journal of Stem Cells, 11(1), 25–36
- Dawson, G., Sun, J. M., Davlantis, K. S., Murias, M., Franz, L., Troy, J., & Kurtzberg, J. (2017). Autologous cord blood infusions are safe and feasible in young children with autism spectrum disorder: results of a single-center phase i open-label Trial. Stem Cells Translational Medicine, 6(5), 1332–1339
- Higgins, J. P. T., & Thomas, J. (2019). Cochrane Handbook for Systematic Reviews of Interventions. Wiley
- Balduzzi, S., Rücker, G., & Schwarzer, G. (2019). How to perform a meta-analysis with R: A practical tutorial. Evidence-Based Mental Health, 22(4), 153–160. https://doi-org.osaka-u.idm.oclc.org/10.1136/ebmental-2019-300117
- Riordan, N. H., Hincapié, M. L., Morales, I., Fernández, G., Allen, N., Leu, C., & Novarro, N. (2019). Allogeneic human umbilical cord mesenchymal stem cells for the treatment of autism spectrum disorder in children: safety profile and effect on cytokine levels. Stem Cells Translational Medicine, 8(10), 1008–1016
- Chez, M., Lepage, C., Parise, C., Dang-Chu, A., Hankins, A., & Carroll, M. (2018). Safety and observations from a placebo-controlled, crossover study to assess use of autologous umbilical cord blood stem cells to improve symptoms in children with autism. Stem Cells Translational Medicine, 7(4), 333–341
- Dawson, G., Sun, J. M., Baker, J., Carpenter, K., Compton, S., Deaver, M., Franz,L., Heilbron, N., Herold, B., Horrigan, J., Howard, J., Kosinski, A., Major, S., Murias,M., Page, K., Prasad, V. K., Sabatos-DeVito, M., Sanfilippo, F., Sikich, L., … Kurtzberg,J. (2020). A Phase II Randomized Clinical Trial of the Safety and Efficacy of Intravenous Umbilical Cord Blood Infusion for Treatment of Children with Autism Spectrum Disorder. The Journal of Pediatrics, 222, 164–173.e5
- Murias, M., Major, S., Compton, S., Buttinger, J., Sun, J. M., Kurtzberg, J., & Dawson, G. (2018). Electrophysiological biomarkers predict clinical improvement in an open-label trial assessing efficacy of autologous umbilical cord blood for treatment of autism. In STEM CELLS Translational Medicine (Vol. 7, Issue 11, pp. 783–791). https://doi-org.osaka-u.idm.oclc.org/10.1002/sctm.18-0090
- Nguyen Thanh, L., Nguyen, H. P., Ngo, M. D., Bui, V. A., Dam, P. T. M., Bui, H. T. P. … Heke, M. (2021). Outcomes of bone marrow mononuclear cell transplantation combined with interventional education for autism spectrum disorder. Stem Cells Translational Medicine, 10(1), 14–26
- Bradstreet, J. J., Sych, N., Antonucci, N., Klunnik, M., Ivankova, O., Matyashchuk, I. … Siniscalco, D. (2014). Efficacy of fetal stem cell transplantation in autism spectrum disorders: an open-labeled pilot study. Cell Transplantation, 23(Suppl 1), S105–S112