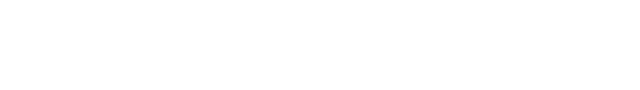ALS
目次
ALSの治療内容
当院の治療内容
幹細胞治療がALSに治療効果を発揮する原理
ALSに対する幹細胞治療のエビデンス、医学研究、医学論文の紹介
幹細胞治療で期待できる体内の効果
ALSに対する幹細胞治療における実際の説明
既存の治療と一般的な治療と比較したメリット
幹細胞治療の流れ
実際に期待できる症状の改善の例
ALSについて、もっと詳しく知りたい方は、以下をご覧ください。
アメリカ、Mayo ClinicでのALSに対する幹細胞治療
※以下、動画の和訳になります。
ALSの治療内容
ALSの治療において、根治療法はありません。
進行抑制のための薬物療法や、対処療法が中心となります。
日本のALS治療ガイドラインでは、病気の進行を管理しながら患者のQOLを高めることが重要視されており、ALSの経過を通じて患者の自律性とコミュニケーションを維持することの重要性も強調しています。
そのために、内科医、理学療法士、作業療法士、呼吸療法士、栄養士、心理士などの医療専門家がチームを組み、ALS患者の多様なニーズに対応しています。
日本や欧米でALSの治療に用いられている主な薬剤はリルゾールです。この薬剤は病気の進行を遅らせ、生存期間を延長させるという点で、それなりの効果を示しています。
また、エダラボンという薬も細胞にダメージを与えるフリーラジカルを除去し、ALSの進行を抑制します。
薬物療法に加えて、日本ではALSに伴う特定の症状に対処するために対症療法が行われています。ボツリヌス毒素注射による筋痙縮の緩和、抗コリン薬による過剰な唾液分泌の抑制(唾液漏)、粘液溶解薬による気管支分泌の抑制、抗うつ薬によるうつ病の抑制などがあります。他にも、病状が進行して言語が不自由になった場合にも効果的なコミュニケーションを可能にする補助器具や技術を提供する努力がなされています。ALS患者さんに声を届けるため、補聴・代替コミュニケーション(AAC)機器、視線追跡システムなどが採用されています。
また、機械的サポートとして、非侵襲的人工呼吸(NIV)や経皮的内視鏡的胃瘻造設術(PEG)などの機械的補助がALS管理に用いられています。NIVは呼吸困難を補助し、PEGは嚥下が困難になったときに十分な栄養を確保します。また、日本では気管切開に基づく侵襲的人工呼吸(TIV)も一般的です。
当院の治療内容
痛みや不安にも配慮した、安心安全な最先端の治療です。
当院では、骨髄幹細胞と造血幹細胞を使ったALS病の治療を行っています。幹細胞による治療は、自身の骨髄から骨髄幹細胞や造血幹細胞を採取し、再び自身の体内に静脈投与する方法です。幹細胞の採取は入院する事もなく、当日行うことが可能です。
また、当院では医師が患者さんのお宅へ出向く在宅診療も行っています。重症のALSの患者さんにも、対応できるのが、当院の強みです。
幹細胞治療がALSに治療効果を発揮する原理
幹細胞とは、私たちの体内にある特殊な細胞で、自己を更新し、異なる種類の細胞に変化することができます。当初は、胚性幹細胞(ESCs)や多能性幹細胞(PSCs)を移植し、損傷した神経細胞を置き換えることに焦点が当てられていましたが、それは予想以上に複雑なことが判明しました。移植された幹細胞は、既存の神経細胞と結合し、病的な環境で生き延びる必要があったからです。
こうした課題を克服するために、幹細胞治療の「近隣理論」が登場しました。この概念によれば、移植された幹細胞は神経細胞を置き換える代わりに、既存の神経細胞をサポートする環境を提供します。幹細胞は神経栄養因子のような有用物質を分泌し、神経細胞以外の細胞(アストロサイトやミクログリアなど)や、調節ニューロン (病気の運動ニューロンと相互作用する) など、さまざまなタイプの細胞に変化することができ、運動ニューロンの変性を遅らせる神経保護環境を作り出します。動物を使った研究では有望な結果が得られており、ALS治療における幹細胞の可能性が示されています。
ALSに対する幹細胞治療のエビデンス、医学研究、医学論文の紹介
筋萎縮性側索硬化症(ALS)は、中枢神経系の運動ニューロンの変性を特徴とする進行性の神経変性疾患で、発症からの平均余命は3~5年です。現在、ALSの治療法はなく、利用可能な治療法は症状を緩和し、病気の進行を遅らせることを目的としています。そこで、幹細胞治療はALS治療の有望な手段として浮上しており、脂肪組織由来の間葉系幹細胞(ADSC)は、その免疫調節・再生特性から治療効果が期待されています。
症例報告
2009年、46歳男性、下肢脱力、階段昇降困難、食事中の咳を呈した症例
総合的な評価によりALSと診断され、病状は急速に悪化し、2013年に自己間葉系幹細胞(ADSC)の合計6回の静脈内注入を受け始めました。治療後には、会話や食事中の咳が止まったと報告し、階段昇降は引き続き困難でしたが、嚥下や会話の問題が少なくなっていました。評価スケールによる全体的な機能性は、わずかに改善し、筋肉の異常な電気活動も見られませんでした。この患者は治療後7年間健康でした。これはALS患者にとって予想以上に長い期間です。
本症例は、自己間葉系幹細胞 (ADSC) の安全な投与が可能であり、ALS患者に有用である可能性を示唆しています。
グリア細胞株由来神経栄養因子 (GDNF) を産生する神経前駆細胞:生体外遺伝子治療アプローチ
この研究では、グリア細胞株由来神経栄養因子(GDNF)と呼ばれる神経栄養因子を産生・分泌する移植細胞の潜在的な有益性を調べています。
一つのアプローチとして、ヒト胎児大脳皮質から作製した神経細胞からなる「ニューロスフィア」を用いた生体外遺伝子治療が研究されています。これらの細胞は、ニューロンやオリゴデンドロサイトには分化しますが、アストロサイトには分化しない二能性の神経前駆細胞(NPC)です。しかし、中枢神経系への移植によって、機能的な利点や運動ニューロンの生存期間の延長がもたらされることはありませんでした。その代わり、ALSモデルにおいて、これらの細胞を頸部に移植することによって、移植片と同側の片側運動ニューロンが生存し、機能するようになりました。
中枢神経系疾患の動物モデルを用いた多くの幹細胞移植研究では、移植細胞が栄養因子や免疫調節分子、またはその他の神経保護因子を産生することによって、有益な効果が観察されています。グリア細胞株由来神経栄養因子 (GDNF) は、実験室環境でも運動ニューロン疾患動物モデルでも、運動ニューロンの生存を促進する能力で知られています。研究者らは、運動ニューロン疾患に関連する変異を持つトランスジェニックラットを用いた実験で、グリア細胞株由来神経栄養因子 (GDNF) を分泌するヒト神経前駆細胞 (hNPC) を移植すると、グリア細胞株由来神経栄養因子 (GDNF) を分泌しないヒト神経前駆細胞 (hNPC) を移植したラットと比較して、生存する運動ニューロンの数が3倍になることを発見しました。しかし、このように運動ニューロンの生存数が増加したにもかかわらず、運動行動や神経筋支配の改善は見られなかったのです。ところが、興味深いことに、グリア細胞株由来神経栄養因子 (GDNF) を発現するヒト神経前駆細胞 (hNPC) をALS(運動ニューロン疾患の一種)のラットの頚髄に移植したところ、手足の運動出力に改善が見られました。このことは、GDNFを産生するヒト神経前駆細胞 (hNPC) の導入が運動機能に良い影響を与えたことを示唆しています。また、研究では、グリア細胞株由来神経栄養因子 (GDNF) を発現するヒト神経前駆細胞 (hNPC) が、ラットの脊髄に移植された後も長期間 (7.5ヵ月) 生存し、グリア細胞株由来神経栄養因子 (GDNF)を分泌し続けたことも発見しました。この発見は、改変された幹細胞が持続的な治療効果をもたらす可能性を示しています。
下の図は、ラットの脊髄にヒト神経前駆細胞 (hNPC) を移植した研究の代表的な画像です。移植ヒト神経前駆細胞 (hNPC) におけるグリア細胞株由来神経栄養因子 (GDNF) の局在と発現を示しています。ラット脊髄内のヒト細胞とグリア細胞株由来神経栄養因子 (GDNF) の存在を可視化するため、特異的抗体を用いて免疫染色を行っています。
以下は異なるパネルの内訳です:
(A – C): ヒト特異的細胞質マーカー (赤) とグリア細胞株由来神経栄養因子(GDNF) (緑) の免疫染色を示します。(A) は10倍、(B) は40倍の倍率で示されています。神経細胞体におけるGDNFの存在 (白矢印) が確認できます。
(C) のパネルでは、移植と反対側(対側)の脊髄腹角におけるGDNF染色が無いことを示しています。この観察は、グリア細胞株由来神経栄養因子 (GDNF) 発現が移植ヒト神経前駆細胞 (hNPC) に特異的であることを示唆しています。
(D)のパネルでは、 ヒト核染色 (赤) と運動ニューロンマーカーであるコリンアセチルトランスフェラーゼ (ChAT) (緑) に対する免疫染色を示しています。この画像は、脊髄の腹角における移植片の局在を確認しています。
(E) ヒト特異的ネスチン (赤) およびヒト特異的グリア線維酸性タンパク質 (GFAP) の免疫染色 (緑) です。これらのマーカーは、移植細胞の生体内試験での表現型を示しています。
画像では、全体として、ラットの脊髄において、移植されたヒト神経前駆細胞 (hNPC) は、グリア細胞株由来神経栄養因子 (GDNF) を安定的に発現していることがわかります。このことは、ヒト神経前駆細胞 (hNPC) 移植を含むこれまでの研究で観察された有益な効果が、移植細胞によるグリア細胞株由来神経栄養因子 (GDNF) のような神経栄養因子の分泌に起因する可能性を示唆しており、中枢神経系における神経保護を促進し、免疫応答を調節する可能性があります。
2016年の間葉系間質細胞分泌神経栄養因子 (MSC-NTF) 細胞を用いた最近の臨床試験
この研究では、MSC-NTF細胞の細胞の髄腔内 (IT) 投与と筋肉内 (IM) 投与が行われ、髄腔内 (IT) 投与と髄腔内 (IT) + 筋肉内 (IM) 投与療法を併用したサブグループにおいて、追跡調査が完了した患者の87%がALS Functional Rating Scale-Revised (ALS患者の機能状態と進行度を測定するためのツール) または強制生命維持能のいずれかに反応し、治療後6ヵ月の時点で進行の度合いが25%以上改善したと評価されました。また、これらの投与に関連した重篤な有害事象はなく、高い安全性を示しています。
研究者たちは、このような治療法が最終的にALSの進行を遅らせたり止めたりすることができるようになり、現在市場に出ている治療薬の成績を大幅に改善することを期待しています。
幹細胞治療で期待できる体内の効果
幹細胞治療では、体内で様々な特殊な細胞に分化する能力を持つ多能性細胞を用います。
ALSでは、脳から筋肉にメッセージを送る役割を担う運動ニューロンが変性し始め、筋力低下や麻痺を引き起こします。ALSの場合、幹細胞治療の治療目標は、損傷した運動ニューロンを置換・支持し、組織を再生させ、神経生存のためのより健康的な微小環境を作り出すことです。それにより、運動機能の改善と神経保護の効果が見られます。
ALSに対する幹細胞治療における実際の説明
ALSは中年期から晩年期に発症し、脊髄と脳で神経細胞の損傷を引き起こし、進行性の筋機能低下と障害をもたらします。
アメリカのメイヨー・クリニックでは、ALSの幹細胞治療として以下のプロセスで臨床研究を行っています。
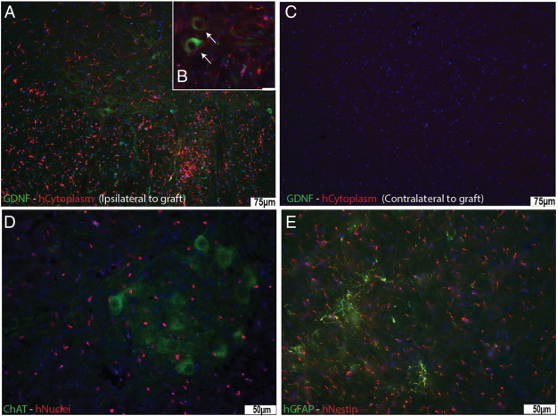
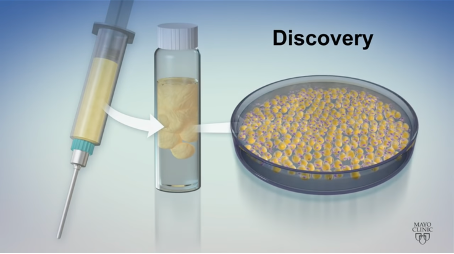
1) 脂肪組織から幹細胞を分離: 腹部を小さく切開し、細胞を取り出します。これらの細胞は特別なバイアルに入れられ、そこから研究室に運ばれます。
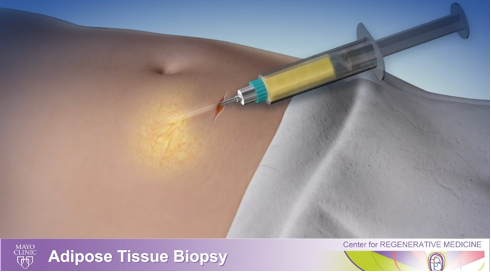
2) 脂肪細胞と幹細胞が分離されます。脂肪細胞は浮き、幹細胞は底に落ち、組織培養皿のプラスチックにくっつきます。
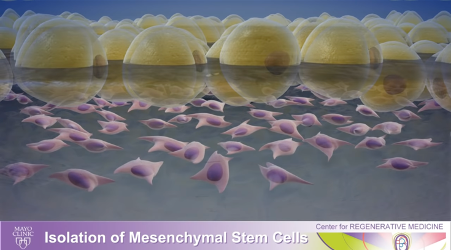
3) そのくっついた幹細胞を分離し、適切な培地を与えることで数百万個の細胞に増殖させることができます。
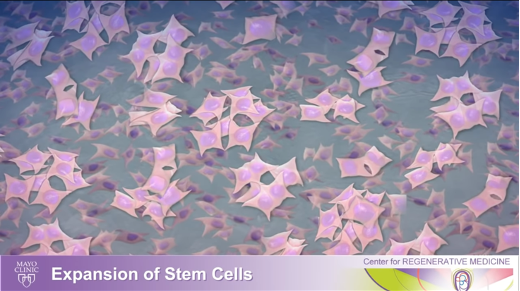
4) 次のステップでは、細胞を選択し、神経細胞を死や損傷から守ることがわかっている成長因子を産生する細胞の成長を促進します。
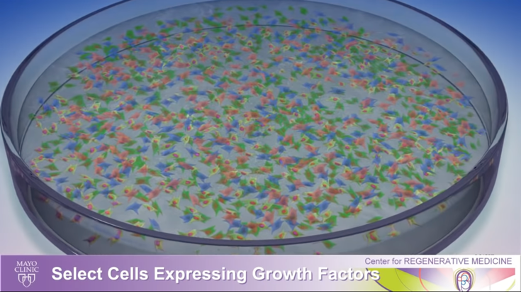
5) こうして選択された細胞は、数十億個の細胞に増殖させることができます。このプロセスは実験室で数週間かけて行われ、最終的には、神経細胞を保護する可能性があるとわかっている成長因子を産生する患者の細胞集団を手に入れることができます。

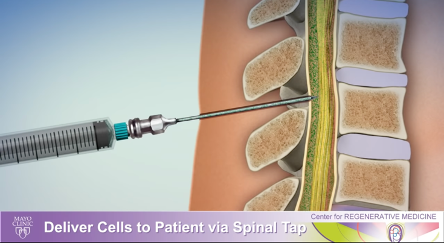
6) 患者さんは臨床研究ユニットに運ばれ、脊髄穿刺によってこれらの細胞が髄液に入れられます。
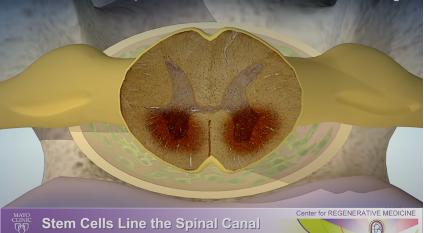
7) 髄液に入ると、細胞は広がり、脊髄と神経根を保護する膜に並べられます。
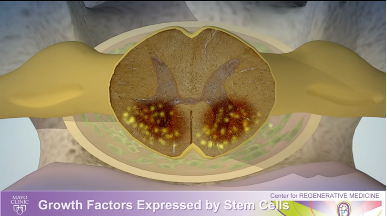
8) 膜に並べられると、神経細胞を死から守るために必要な成長因子が分泌されるようになります。神経細胞を守ることで機能を維持し、ALSの進行を食い止めたり、遅らせたりすることができるます。
既存の治療と一般的な治療と比較したメリット
筋萎縮性側索硬化症 (ALS) は進行性の神経変性疾患であり、運動ニューロンが侵され、筋力低下と萎縮を引き起こします。残念ながら、現在のところALSを治療する方法はなく、既存の治療法は主に症状の管理と病気の進行を遅らせることを目的としています。
幹細胞治療は、病気の進行と関連する様々な根本的な原因に対処できるという利点があります。幹細胞、特に間葉系幹細胞 (MSCs)は、損傷した運動ニューロンを置換し、神経系の患部に切望される細胞置換を提供する可能性を持っています。
また、ALSは非常に不均一な疾患であり、様々な遺伝的・分子的サブタイプがその多様性に寄与しています。幹細胞治療には、個々の患者の疾患特性やニーズを考慮した個別化治療という利点があります。このようなオーダーメイドのアプローチは、治療効果を高め、転帰を改善する可能性を秘めています。
幹細胞治療の流れ
当院での治療の流れを説明します。大まかな流れとして、まず患者さんの骨髄を採取して、静脈に点滴で幹細胞を移植します。1回治療を行い、3か月後に治療効果を判定し、次回以降の治療を決定します。患者さんの病気の状況次第で臨機応変に対応いたします。ここで、骨髄幹細胞を取る際の方法として、骨髄穿刺と脊髄穿刺を混同している患者さんが多く見受けられます。
実際に期待できる症状の改善の例
ウクライナの幹細胞治療センターでは幹細胞によりALSを治療することで得られる効果を以下の通り報告しています。
- 筋力の増加
- 四肢の可動域の広がり
- 歩行の改善
- 筋攣縮の減少
- 食事中の咳き込み減少、嚥下の正常化
ALSについて、もっと詳しく知りたい方は、以下をご覧ください。
1.ALSの疫学
主に中年以降に発症し、一次運動ニューロン(上位運動ニューロン)と二次運動ニューロン(下位運動ニューロン)が選択的にかつ進行性に変性・消失していく原因不明の疾患である。病勢の進展は比較的速く、人工呼吸器を用いなければ通常は2~5年で死亡することが多い。
2.ALSの病態
ほとんどのALS患者は,手(最も多い)または足の痙攣,筋力低下,および筋萎縮から成るランダムな非対称性の症状を訴えて受診する。筋力低下は,前腕,肩,および下肢に進行する。程なくして線維束性収縮,痙縮,深部腱反射亢進,伸展性足底反応,巧緻運動障害,硬直した動き,体重減少,疲労,ならびに顔の表情および舌の動きの制御困難が生じる。
その他の症状としては,嗄声,嚥下困難,言語不明瞭などがあり,嚥下が困難になるために,唾液が増加するようであり,患者は液体でむせやすくなる。
疾患の後期には,情動調節障害(pseudobulbar affect)が生じ,不適切で不随意かつ制御不能の過剰な笑いや号泣がみられる。感覚系,意識,認知,自発的眼球運動,性機能,ならびに尿道および肛門括約筋は通常保たれる。
3.ALSの原因
筋萎縮性側索硬化症(amyotrophic lateral sclerosis:ALS)のうち約5%は家族歴を伴い、家族性筋萎縮性側索硬化症(家族性ALS)とよばれる。家族性ALSの約2割では、フリーラジカルを処理する酵素の遺伝子の変異が報告されている(ALS1)。その他にも、原因遺伝子が次々に報告されている。孤発性ALSの病態としては、フリーラジカルの関与やグルタミン酸毒性により神経障害をきたすという仮説が有力である。また、孤発性ALSの多数症例を用いてゲノムワイドに疾患感受性遺伝子を探索する研究も進行中である。
4.ALSの症状
ALSは発症様式により、(1)上肢の筋萎縮と筋力低下が主体で、下肢は痙縮を示す上肢型(普通型)、(2)構音障害、嚥下障害といった球症状が主体となる球型(進行性球麻痺)、(3)下肢から発症し、下肢の腱反射低下・消失が早期からみられ、二次運動ニューロンの障害が前面に出る下肢型(偽多発神経炎型)の3型に分けられることがある。これ以外にも、呼吸筋麻痺が初期から前景となる例や体幹筋障害が主体となる例、認知症を伴う例もあり多様性がみられる。
5.ALSの合併症
球麻痺・仮性球麻痺による嚥下障害のため、誤嚥性肺炎を生じやすい。筋力低下や呼吸筋麻痺のために喀痰排出が困難で気道感染症や窒息が高頻度。一般に慢性神経疾患に多い褥瘡と尿路感染症は非常に少ない(陰性徴候)
6.ALSの診断
ALSの診断は、①上位および下位運動ニューロン障害の存在②進行性の経過③除外診断によってなされる。ALSの生化学的診断マーカーは現時点で存在していないので、臨床所見と補助検査所見を総合して診断する。
(1)以下の①~④の全てを満たすものを、筋萎縮性側索硬化症と診断する。 ①成人発症である(生年月日から判断する。)。 ②経過は進行性である。 ③神経所見・検査所見で、下記の1か2のいずれかを満たす。 身体を、a.脳神経領域、b.頸部・上肢領域、c.体幹領域(胸髄領域)、d.腰部・下肢領域の4領域に分ける(領域の分け方は、2 参考事項を参照)。 下位運動ニューロン徴候は、(2)針筋電図所見(①または②)でも代用できる。 1.1つ以上の領域に上位運動ニューロン徴候を認め、かつ2つ以上の領域に下位運動ニューロン症候がある。 2.SOD1遺伝子変異など既知の家族性筋萎縮性側索硬化症に関与する遺伝子異常があり、身体の1領域以上に上位及び下位運動ニューロン徴候がある。 ④鑑別診断で挙げられた疾患のいずれでもない。
(2)針筋電図所見 ①進行性脱神経所見:線維束性収縮電位、陽性鋭波、線維自発電位。 ②慢性脱神経所見:運動単位電位の減少・動員遅延、高振幅・長持続時間、多相性電位。
(3)鑑別診断 ①脳幹・脊髄疾患:腫瘍、多発性硬化症、頸椎症、後縦靱帯骨化症など。 ②末梢神経疾患:多巣性運動ニューロパチー、遺伝性ニューロパチーなど。 ③筋疾患:筋ジストロフィー、多発性筋炎、封入体筋炎など。 ④下位運動ニューロン障害のみを示す変性疾患:脊髄性進行性筋萎縮症など。 ⑤上位運動ニューロン障害のみを示す変性疾患:原発性側索硬化症など。
7.ALSの予後
症状の進行は比較的急速で、発症から死亡までの平均期間は約3.5年といわれているが、正確な調査はなく、個人差が非常に大きい。進行は球麻痺型が最も速いとされ、発症から3か月以内に死亡する例もある。一方では、進行が遅く、呼吸補助無しで10数年の経過を取る例もあり、症例ごとに細やかな対応が必要となる。
8.ALSの罹患した著名人
- ホーキング博士
- 毛沢東
- 徳田虎雄
- 篠沢秀夫
- 佐伯チズ